研究概要
ヒトなど高等動物が持つ精神機能は、複雑で精巧な脳の組織が正常に形作られることで初めて獲得されます。この脳の健やかな発達には多くの遺伝子が関わっており、一つまたは少数の遺伝子の働きが損なわれただけでも、脳の発達に障害が起き、様々な心の病気、すなわち精神発達障害が引き起こされます。近年、ゲノム解析などの飛躍的な技術発展によって、数多くの精神発達障害に関わる原因遺伝子が同定されてきましたが、病気が引き起こる分子メカニズムは未だ不明な点が多く残されており、有効な治療法も確立されていません。
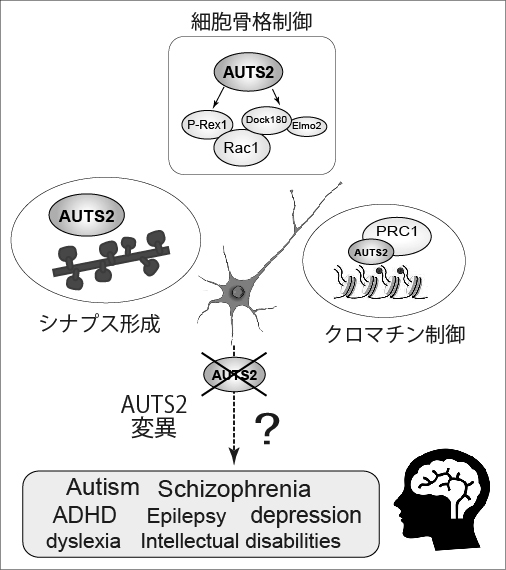
私たちの研究グループでは、脳の発達に関わる遺伝子の中で近年注目を集めており、様々な精神疾患に関わるAUTS2遺伝子(autism susceptibility candidate 2)に着目して研究を行なっています。AUTS2遺伝子は、自閉症を発症する患者で欠損している遺伝子として2002年に初めて報告されましたが、その後、統合失調症や注意欠如・多動症(ADHD)、失語症、小頭症、てんかんなどの患者でもこの遺伝子に変異が見つかり、幅広い脳の病気と関連する遺伝子として注目されています。AUTS2遺伝子から作られるAUTS2タンパクは、大脳皮質や海馬、小脳といった、脳の中でも特に高いレベルでの精神機能を担う脳領域で高く発現していることから、脳の高次機能形成に重要な役割を果たしていると推測されています。しかし長い間、AUTS2の具体的な機能は明らかにされず、この遺伝子の異常がどのようにして心の病気を引き起こしているのかは分かっていませんでした。そこで私たちは、Auts2遺伝子を壊したマウス(ノックアウトマウス、KO)を疾患動物モデルとして利用し、解剖学、発生学、分子生物学的手法を駆使してこのマウス脳を調べることにより、これまで以下の様なことを明らかにしてきました。
【細胞質AUTS2による神経細胞の運動・形態形成の制御】
AUTS2タンパクは神経細胞の細胞質や核内に局在します。核内でAUTS2は、エピジェネティック制御因子であるPolycomb repressive complex 1(PRC1)と相互作用し、ヒストン修飾を介した遺伝子の発現制御に関わることが、海外の研究グループから報告されていましたが(Gao et al., 2014, Nature)、細胞質での役割については不明でした。
私たちは、細胞質に存在するAUTS2が、P-Rex1やElmo2/Dock180といったRac1やCdc42などの低分子量Gタンパクの上流因子と相互作用してアクチンや微小管などの細胞骨格を制御し、胎児期から乳児期の大脳皮質内で起こる神経細胞移動や神経突起の伸展などを調節するタンパク質であることを報告しました(Hori et al. 2014, Cell Rep)。AUTS2 KOマウスの脳内では野生型マウスと比べて脳室帯から生み出された後の神経細胞の移動が遅く、また、その後の神経突起の伸長や枝分かれも悪く貧弱な神経形態を示す様子が観察されました。


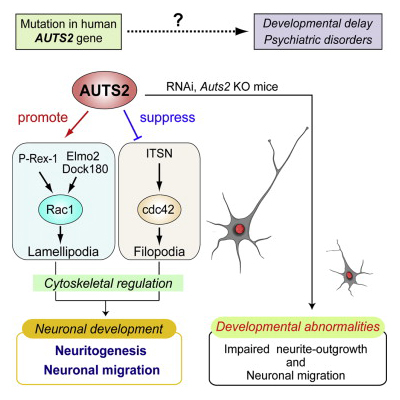
【AUTS2によるシナプスの形成や恒常性維持の制御】
AUTS2は成熟した成人の脳にも存在しますが、その働きについてはほとんど分かっていませんでした。そこで私たちは、生後、脳が発達していく過程で活発に作られる「シナプス」に着目し、AUTS2がシナプス形成に果たす役割を調べました。脳内の神経細胞は、神経活動を促す「興奮性シナプス」と、逆にそれを抑え込む「抑制性シナプス」で繋がっており、これらの数がバランスよく保たれることで、健やかな精神活動が営まれます。私たちは、AUTS2が興奮性シナプスの新規形成を抑え、興奮性シナプスの数が増えすぎないように調整していることを見出しました。一方で、抑制性シナプスに対してはこのような働きがありません。AUTS2の機能が失われると過剰に興奮性シナプスが作られる一方、抑制性シナプスの数は変わらないため、結果的に神経回路の興奮/抑制バランスが破綻してしまい、脳が常に興奮した状態になっていることがわかりました(Hori et al., 2020, iScience)。
また、 Auts2 KOマウスを用いて様々な行動解析を行なったところ、社会性の低下(仲間のマウスに興味を示さない)や記憶力の低下、音声を用いたコミュニケーションが乏しくなるなど、ヒトの自閉症や知的障がいなどの様な症状を示すこともわかりました(Hori et al., 2015., PLoS One; Hori et al., 2020, iScience)。 今回の発見から、AUTS2遺伝子の変異を持つ患者さんでは、脳内の興奮性/抑制性シナプスバランスが破綻した結果、精神症状が引き起こされるのではないかと考えられます。

マウス大脳ニューロンをGolgi染色によって可視化したところ、正常マウスと比べて、Auts2変異マウスでは樹状突起上に過剰なスパイン(興奮性シナプス)が形成される

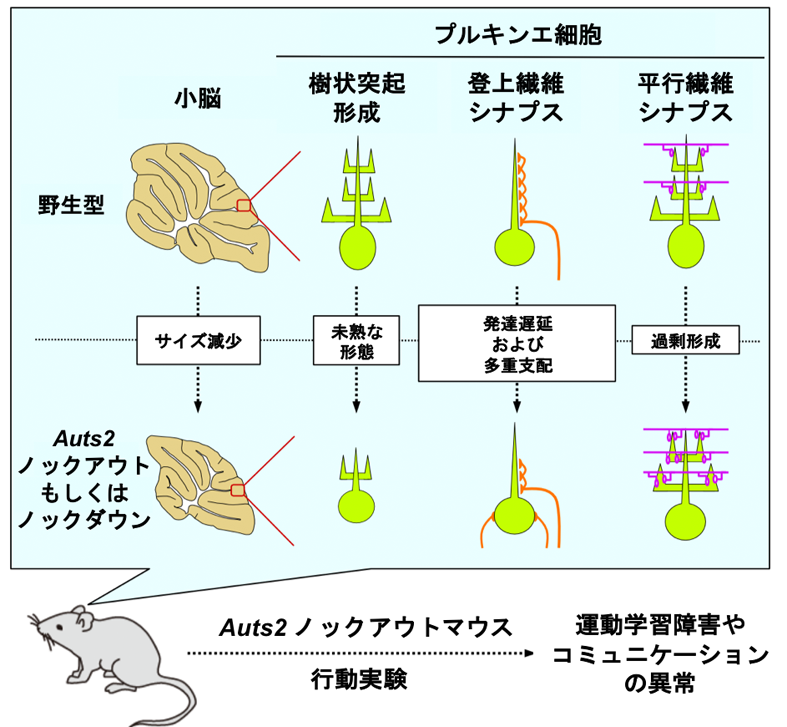
【小脳発達におけるAUTS2の役割】
小脳は運動の中枢として知られていますが、近年の研究から、より高次な精神活動にも関わる可能性が示唆されています。また、小脳の発達不全が自閉症などの精神疾患を引き起こす可能性についても指摘されていますが、病態機序の詳細は分かっていません。私たちは、小脳発達におけるAUTS2の役割を調べるため、小脳を含むごく一部の脳組織のみでAuts2をKOしたマウス(Auts2コンディショナルKOマウス、Auts2 cKO)を作製したところ、正常なマウスと比べて小脳が小さくなっていました。また、小脳神経細胞の一つ、プルキンエ細胞の数が減少しており、さらに、その樹状突起の成長速度が遅く、枝分かれ構造の乏しい未熟な細胞形態を示していました。プルキンエ細胞は、小脳内で処理された情報を上位の脳へと伝える出力細胞として働きます。この情報伝達はプルキンエ細胞上に形成される2種類の興奮性シナプスを介して行われます。ひとつは、下オリーブ核から投射される神経繊維との間に「登上繊維シナプス」を、もう一つは小脳内の顆粒神経細胞から伸びる神経繊維との間に「平行繊維シナプス」を作ります。登上繊維シナプスは、プルキンエ細胞の樹状突起に沿って入力繊維が登上しながらプルキンエ細胞の樹状突起上にシナプスを形成します。この登上繊維シナプスの進展速度がAuts2 cKOマウスでは遅く、その数が少なっていました。これとは逆に、平行繊維シナプスは通常よりも過剰に作られていることが分かりました。さらに、このAuts2 cKOマウスは運動の学習能力が低下しており、また興味深いことに、音声コミュニケーションがうまく取れないなど、自閉症によく似た症状も示すことが分かりました。つまり、小脳でのAUTS2の機能が失われると、運動制御のみならず、コミュニケーション能力など、より高次の精神機能も障害されることが示めされました。


【現在進行中の研究】
Auts2 KOマウスの脳サイズは野生型マウスよりも全体的に小さく、特に大脳皮質や海馬組織の一部である歯状回、小脳などでその差が顕著に現れます。私たちは、AUTS2が下流の様々な遺伝子の発現を制御しながら、神経細胞の生み出し(neurogenesis)にも関わっていることを見出しつつあります。また、前述のシナプス形成にも核内で働くAUTS2が関わっていることもわかってきました。しかしながら、神経細胞が新たに生み出される過程やシナプス形成を制御する過程で、AUTS2がどの様な遺伝子の発現を調節しているのか、また、AUTS2は他のどの様なタンパクと相互作用しているのか、そういった詳しい分子メカニズムはまだよく分かっていません。そこで現在私たちは、AUTS2の下流遺伝子群を網羅的に同定するRNAシークエンスやChIPシークエンスを用いたトランスクリプトーム解析(RNA-seqなど)、ゲノミクス解析(ChIP-seqなど)、また、質量分析によるプロテオミクス解析によって、AUTS2と結合するタンパクの同定を試みています。これまでの生化学・分子生物学的な手法に加え、バイオインフォマティクスなどの新しいサイエンスを取り入れながら、AUTS2の分子機能や機能的なタンパクネットワークを明らかにしていくことで、精神発達障害が発症するメカニズムをよりよく理解し、将来的に新たな治療法開発に貢献できればと考えています。

