What’s news
2025年4月1日
・本年度から北里大学4年生の伊藤創太郎さんが研究チームに合流してくれます。
2025年3月14日
・博士学生の陶山京香さんが第18回神経発生討論会において「生後マウス小脳におけるバーグマングリア様前駆細胞の系譜解析と多能性維持に重要な遺伝子の探索 」という表題でポスター発表を実施しました。
・リサーチフェローの足立透真博士が第18回神経発生討論会において「小脳バーグマングリア様前駆細胞の運命決定時における転写因子ZEB2とZEB1の相補的機能の解明 」という表題でポスター発表を実施しました。
2024年11月30日
・リサーチフェローの足立透真博士が第47回日本神経組織培養研究会において「小脳アストログリア運命決定時の転写因子 ZEB2 と ZEB1 の相補的機能の解明 」という表題で口頭発表(一般)を実施しました。
2024年9月27日
・リサーチフェローの足立透真博士が2025年度日本学術振興会特別研究員(PD)に採用内定されました。
2024年7月25日
・博士学生の陶山京香さんがNeuro2024において「A detailed exploration of the progeny cell types produced by cerebellar Bergmann glia like progenitor
」という表題で、修士学生の水野美波さんが「Exploring the function of transcription factor MEIS1 in cerebellar glial cell development」という表題でポスター発表を実施しました。
2024年7月24日
・リサーチフェローの足立透真博士がNeuro2024において「Molecular Mechanisms Regulating Bergmann gliogenesis and Astrogliogenesis in Cerebellum
」という表題で一般口演を実施しました。
2024年7月1日
・リサーチフェローの足立透真博士が公益財団法人武田科学振興財団 様の医学系研究助成の交付対象として認定されました。
2024年3月1日
・リサーチフェローの足立透真博士が2023年度 神経研究所所内発表会においてポスター発表を実施し、優秀ポスター発表賞を受賞しました。
2023年12月2日
・リサーチフェローの足立透真博士が第46回日本神経組織培養研究会において「小脳発生期のアストログリア生み分け機構についての研究」という表題で口頭発表(一般)を実施しました。
2023年11月12日
・リサーチフェローの足立透真博士がSociety for neuroscience 2023において「Functional elucidation of the transcription factor MEIS1 during fate determination of cerebellar astroglial cells」という表題でポスター発表を実施しました。
2023年10月24日
・AI班 班会議においてリサーチフェローの足立透真博士が口頭発表を実施しました。
2023年10月19日
・ゲノム編集班 班会議においてリサーチフェローの足立透真博士が口頭発表を実施しました。
2023年9月22日
・NCNP 若手の会においてリサーチフェローの足立透真博士が口頭発表を実施しました。
2023年8月2日
・リサーチフェローの足立透真博士が第46回日本神経科学大会において「小脳アストログリア細胞の発生における転写因子MEIS1の機能解析」という表題でポスター発表を実施しました。
2023年6月21日
・リサーチフェローの足立透真博士がThe Asian Pacific Society for Neurochemistry APSN 2023において「Function of transcription factor Meis1 in the differentiation of Bergmann glia from astroglial progenitor」という表題で口頭発表(YIC招待講演)を実施しました。
2023年4月1日
・リサーチフェローの足立透真博士が「二段階神経細胞産生に関わる小脳・大脳皮質共通の分子基盤と生物学的意義の探索」という表題で日本学術振興会(JSPS)の若手研究(23K14203)に採択されました。
・本年度から東京医科歯科大学博士1年生のJi Kaiyuanさんと北里大学4年生の水野美波さんが研究チームに合流してくれます。
2023年3月31日
・東京大学博士4年生の一條研太朗さんが「小脳バーグマングリアの発生における転写因子MEIS1の機能解析」という表題で博士号を取得しました。
2023年3月10日
・リサーチフェローの足立透真博士が「小脳アストログリア細胞の発生における転写因子MEIS1の機能解析 」という表題で第16回神経発生討論会にて口頭発表を実施しました。
2023年2月21日
・リサーチフェローの足立透真博士が公益財団法人金原一郎医学医療振興財団 様の「第37回研究交流助成金」の交付対象として認定されました。
2023年1月10日
・リサーチフェローの足立透真博士がThe Asian Pacific Society for Neurochemistry APSN 2023のYoung Investigator Colloquiums (YIC) として採択されました。
研究概要
脳がどのように形成されるかを理解することは、どのように我々が知性を獲得し、そして、どのようにその機能が損なわれて、病気になってしまうのかを学ぶことに繋がります。しかしながら、複雑精緻な構造と機能を持つ脳がどのように作られ、維持されていくのか、その詳細な機構に関しては、依然として多くの謎が存在します。
私たちはこれらの謎に答えるために、脳発生に重要な分子的、細胞生物学的基盤を明らかにするための研究を、主に小脳に着目して実施しています。
脳には、多種多様な神経細胞がそれぞれ適正な数だけ存在し、正常な脳機能を支える基盤となっています。しかしながら、「限られた遺伝情報から、(A)多様な神経細胞・グリア細胞を分別して生み出す仕組み、そして、 (B)それぞれの種類の神経細胞・グリア細胞を適切なタイミングで適切な数だけ生み出す仕組み」については、まだまだ未解明な点が多いのが現状です。これまでに私たちは、マウス小脳をモデル系としてこの神経科学上の重要な問題に取り組んできました。(A)については抑制性神経細胞と興奮性神経細胞を生み分ける重要な転写因子(PTF1A, ATOH1)の機能の解明(Neuron 2005 , J. Neurosci 2007, Development 2009, J. Neurosci 2014, Cell Rep 2018)と、プルキンエ細胞と介在ニューロン(どちらも抑制性神経細胞)を転写因子(OLIG2,GSX1)で生み分ける仕組みの解明(Nature Communications 2014)によって報告をしてきました。また、「(B)それぞれの神経細胞種を適切なタイミングで適切な数だけ生み出す仕組み」については、小脳顆粒細胞前駆細胞(Granule Cell Progenitors, GCPs)の増殖と顆粒細胞(Granule Cells, GCs)への分化をモデル系として、そのメカニズムの一端を明らかにしてきました(J. Neurosci 2018, EMBO J 2021, eNeuro 2021)。
私たちはこれからも、上記に示した(A),(B)の疑問に答えるために、研究を進めていく予定です。以下に、これまで私たちの研究でわかったことの一部と、現在私たちが実施している研究を示します。
【1.転写因子MEIS1の小脳発生における機能解明】
Myeloid ecotropic viral integration site 1(MEIS1)はホメオドメイン転写因子であり、発生期から成体期にかけて、様々な組織や一部の腫瘍で発現していることが知られています。MEIS1は中枢神経系、特に小脳皮質においても強い発現を示します。私たちはこれまでに、MEIS1を小脳顆粒細胞特異的に欠損させると、小脳形成が著しく阻害されることを発見しました。そして、その現象が、転写因子PAX6やBMPシグナルを介した、MEIS1による小脳顆粒細胞前駆細胞の分化状態の制御機構の破綻の結果であることを示しました(図1, J. Neurosci 2018)。
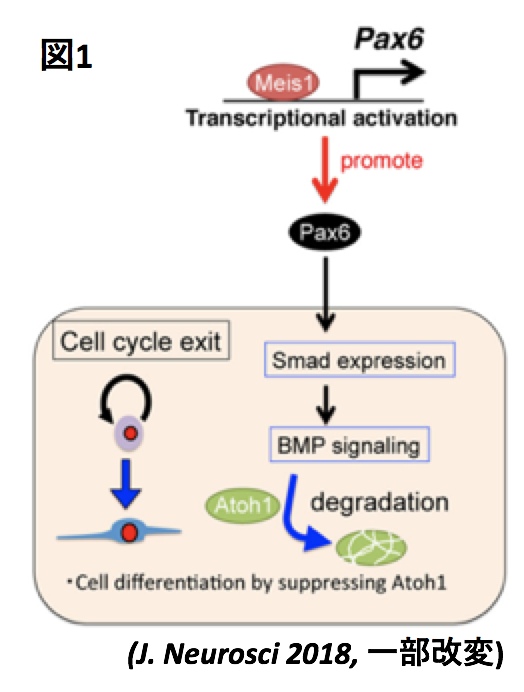
上記の研究は中枢神経系のMEIS1の機能について詳細に解明した、世界で初めての研究成果ですが、小脳発生における転写因子 MEIS1の機能は依然として未解明な点も多いです。
私たちは現在、「MEIS1の小脳顆粒細胞以外の発生における機能」、そして、「その機能が阻害された結果引き起こされる発達障害に関しての研究」をマウスモデル、分子生物学的、生化学的な手法、バイオインフォマティクス解析などを主に用いて実施しております。また、「MEIS1のアイソフォームごとの異なる機能の探究」も実施しています(https://doi.org/10.1101/2022.08.17.504235)。
これらの研究を通じて、中枢神経系においてMEIS1の担う機能を、包括的に明らかにできればと考えております。
【2.小脳顆粒細胞前駆細胞における増殖・分化のタイミングの制御メカニズムの解明】
小脳は長年運動機能の制御において重要であると考えられてきましたが、ここ10年の研究において、社会性や報酬系などの高次機能への関与も報告され始めた脳部位です。さらに、小脳皮質は大脳皮質と同様に、進化的に霊長目へと近づくにつれて皮質構造が拡大している脳部位でもあります。
小脳の体積はほぼ小脳顆粒細胞の数に比例して増大しており、小脳顆粒細胞は霊長目において顕著にその数を増加させています。
小脳顆粒細胞は、進化の過程でその数を爆発的に増やした細胞であることから、大脳皮質のような二次、三次増殖性の神経前駆細胞を介した二段階の神経細胞産生機構が存在するのではないかと予想されてきましたが、最近までその存在は明らかになっていませんでした。
私たちはこれまでの研究において、マウスの小脳顆粒細胞の前駆細胞である小脳顆粒細胞前駆細胞(GC Progenitors, GCPs)には「未分化なATOH1陽性GCPs(AT+GCPs)」と「少し分化したNEUROD1陽性GCPs(ND+GCPs)」の二種類が存在し、小脳発生過程でAT+GCPsが少しずつND+GCPsへと遷移すること(AT-ND Transition)を報告しました(EMBO J 2021)。また、小脳顆粒細胞前駆細胞同士におけるNotchシグナルを介した細胞間伝達によって、このAT-ND Transitionが制御されていることを示しました(図2, eNeuro 2021)。
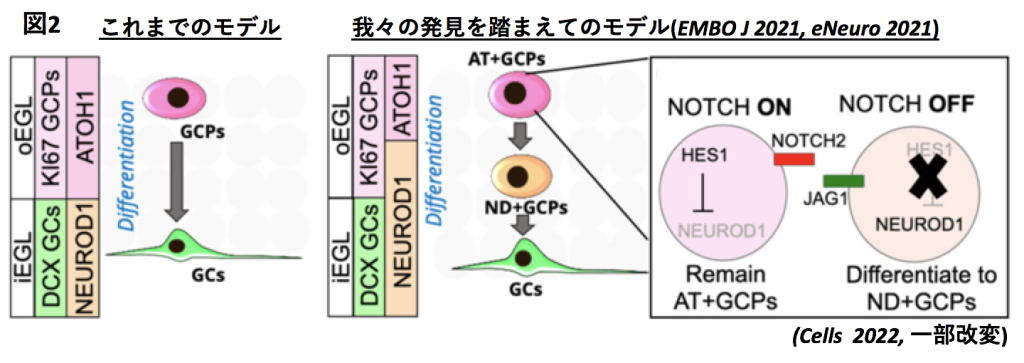
興味深いことに、ND+GCPsは爬虫類や鳥類には存在せず、哺乳類から獲得された細胞種です。これらの研究を踏まえて、私たちは現在、それぞれのGCPsが分裂時と分化時にどのような挙動を示すのか、また、ND+GCPsの獲得が進化的にどのような意義を持つのかに関して研究を進めています。
研究業績
Owa T, Shiraishi R, Adachi A, Miyashita S, Ichijo K, Nishioka T, Taya S, Kaibuchi K, Hoshino M. Homeodomain-less MEIS1 suppresses CUL3-dependent ATOH1 degradation to regulate cerebellar granule cell development. Biorxiv 2022. doi:10.1101/2022.08.17.504235
Miyashita S, Hoshino M. Transit amplifying progenitors in the cerebellum: Similarities to and differences from transit amplifying cells in other brain regions and between species. Cells. 2022 Feb 18;11(4): 726. doi: 10.3390/cells11040726.
Miyashita S, Owa T, Seto Y, Yamashita M, Aida S, Sone M, Ichijo K, Nishioka T, Kaibuchi K, Kawaguchi Y, Taya S, Hoshino M. Cyclin D1 controls development of cerebellar granule cell progenitors through phosphorylation and stabilization of ATOH1. EMBOJ 2021 Jul 15; 40(14): e105712. doi: 10.15252/emboj.2020105712.
Adachi T, Miyashita S, Yamashita M, Shimoda M, Okonechnikov K, Chavez L, Kool M, Pfister SM, Inoue T, Kawauchi D, Hoshino M. Notch Signaling between Cerebellar Granule Cell Progenitors. eNeuro. 2021:ENEURO.0468-20.
Yamashita M, Owa T, Shiraishi R, Adachi T, Ichijo K, Taya S, Miyashita S, Hoshino M. The role of SCFSkp2 and SCFβ-TrCP1/2 in the cerebellar granule cell precursors. Genes to Cells. 2020 Oct 6. doi: 10.1111/gtc.12813.
Shiraishi RD, Miyashita S, Yamashita M, Adachi T, Shimoda MM, Owa T, Hoshino M. Expression of transcription factors and signaling molecules in the cerebellar granule cell development. Gene Expr Patterns. 2019 Dec;34:119068. doi: 10.1016/j.gep.2019.119068. Epub 2019 Aug 20.PMID: 31437514
Fujiyama T, Miyashita S, Tsuneoka Y, Kanemaru K, Kakizaki M, Kanno S, Ishikawa Y, Yamashita M, Owa T, Nagaoka M, Kawaguchi Y, Yanagawa Y, Magnuson MA, Marutani M, Shibuya A, Nabeshima Y, Yanagisawa M, Funato H and Hoshino M. Forebrain Ptf1a is required for sexual differentiation of the brain.
Cell Rep., 2018 July 3; 24(1):79-94. doi:10.1016/j.celrep.2018.06.010
Owa T, Taya S, Miyashita S, Yamashita M, Adachi T, Yamada K, Yokoyama M, Aida S, Nishioka T, Inoue YU, Goitsuka R, Nakamura T, Inoue T, Kaibuchi K, Hoshino M:
Meis1 Coordinates Cerebellar Granule Cell Development by Regulating Pax6 Transcription, BMP Signaling and Atoh1 Degradation.
J Neurosci, 2018 Jan 31;38(5):1277-1294. doi: 10.1523/JNEUROSCI.1545-17.2017. Epub 2018 Jan 9.
Miyashita S*, Adachi T*, Yamashita M, Sota T, Hoshino M: Dynamics of the cell division orientation of granule cell precursors during cerebellar development.
Mech Dev, 2017 Oct;147:1-7. doi: 10.1016/j.mod.2017.06.002. Epub 2017 Jun 17. *These authors contributed equally.
Hashimoto R, Hori K, Owa T, Miyashita S, Dewa K, Masuyama N, Sakai K, Hayase Y, Seto Y, Inoue YU, Inoue T, Ichinohe N, Kawaguchi Y, Akiyama H, Koizumi S, Hoshino M:Origins of oligodendrocytes in the cerebellum, whose development is controlled by the transcription factor, Sox9.
Mech Dev, May;140:25-40. doi: 10.1016/j.mod.2016.02.004. Epub 2016 Mar 3.
Leto K, Arancillo M, Becker EB, Buffo A, Chiang C, Ding B, Dobyns WB, Dusart I, Haldipur P, Hatten ME, Hoshino M, Joyner AL, Kano M, Kilpatrick DL, Koibuchi N, Marino S, Martinez S, Millen KJ, Millner TO, Miyata T, Parmigiani E, Schilling K, Sekerková G, Sillitoe RV, Sotelo C, Uesaka N, Wefers A, Wingate RJ, Hawke: Consensus paper: cerebellar development. Cerebellum, 2016 Dec;15(6):789-828. Review.
De Luca A, Parmigiani E, Tosatto G, Martire S, Hoshino M, Buffo A, Leto K, Rossi F: Exogenous Sonic Hedgehog modulates the pool of GABAergic interneurons during cerebellar development. Cerebellum, 14, 72-85, 2015.
Seto Y, Nakatani T, Masuyama N, Taya S, Kumai M, Minaki Y, Hamaguchi A, Inoue YU, Inoue T, Miyashita S, Fujiyama T, Yamada M, Chapman H, Campbell KJ, Magnuson MA, Wright CV, Kawaguchi Y, Ikenaka K, Takebayashi H, Ishiwata S, Ono Y, Hoshino M: Temporal identity transition from Purkinje cell progenitors to GABAergic interneuron progenitors in the cerebellum. Nature Communications, 5, 3337, 2014.
Yamada M, Seto Y, Taya S, Owa T, Inoue YU, Inoue T, Kawaguchi Y, Nabeshima Y, Hoshino M. Specification of spatial identities of cerebellar neuronal progenitors by Ptf1a and Atoh1 for proper production of GABAergic and glutamatergic neurons.
J. Neurosci, 34, 4786-4800, 2014.
Seto Y, Ishiwata S, Hoshino M: Characterization of Olig2 expression during cerebellar development. Gene Expression Patterns, 15, 1-7, 2014.
Kawauchi T, Sekine K, Shikanai M, Chihama K, Tomita K, Nakajima K, Nabeshima Y, Hoshino M: Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-Cadherin trafficking. Neuron, 67, 588-602, 2010.
Fujiyama T, Yamada M, Terao M, Terashima T, Hioki H, Inoue YU, Inoue T, Masuyama N, Obata K, Yanagawa Y, Kawaguchi Y, Nabeshima Y, Hoshino M:
Inhibitory and excitatory subtypes of cochlear nucleus neurons are defined by distinct bHLH transcription factors, Ptf1a and Atoh1. Development, 136, 2049-2058, 2009.
Yamada M, Terao M, Terashima T, Fujiyama T, Kawaguchi Y, Nabeshima Y, Hoshino M: Origin of climbing fiber neurons and their developmental dependence on Ptf1a. J. Neurosci., 27, 10924-10934, 2007)
Kawauchi T, Chihama K, Nabeshima Y, Hoshino M: Cdk5 phosphorylates and stabilizes p27kip1, contributing to actin organization and cortical neuronal migration. Nature Cell Biol. 8, 17-26, 2006
Hoshino M, Nakamura S, Mori K, Kawauchi T, Terao M, Nishimura YV, Fukuda A, Fuse T, Matsuo N, Sone M, Watanabe M, Bito H, Terashima T, Wright CVE, Kawaguchi Y, Nakao K, Nabeshima Y: Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron, 47, 201-213, 2005

