川内 大輔
脳腫瘍は小児の腫瘍の中で最も死亡率が高い疾患であり、個々の腫瘍の個性に応じた個別化治療の必要性が提唱されています。私たちは国内外の腫瘍研究者、臨床研究者と連携して、様々な脳腫瘍の個性を世界最先端の技術と知識を用いて、脳神経とがんの基礎研究の観点から明らかにし、それを基盤とした脳腫瘍研究の治療法の発展に貢献したいと考えています。
What’s News

川内が次世代がん医療加速化研究事業(P-PROMOTE)https://www.amed.go.jp/program/list/11/01/007.html 領域Aと領域Bにそれぞれ研究代表者および分担研究者(代表:TMDU上阪直史教授)として採択されました。領域Aは脳腫瘍のエピゲノム研究、領域Bはがんと神経のコミュニケーションに関する研究です。皆様よろしくお願い致します。

川内が東京医科歯科大学上阪直史教授との共同研究内容「Conditional expression and activation of DREADDs reveals novel impact of neuron-tumor communications on brain tumor progression」をCancer Neuroscience Conference heidelberghttps://cancerneuroscience.de/conference/で口頭発表しました。脳腫瘍と神経細胞のコミュニケーションの話です。興味がある方は連絡ください。
ドイツ脳腫瘍研究基金「Ein KIWI gegen Krebs」https://www.ein-kiwi-gegen-krebs.de/の募金活動に川内グループが日本からチーム写真を撮影して参加しました。小児がんを全世界でチームを組んで治しましょうという取組みです。
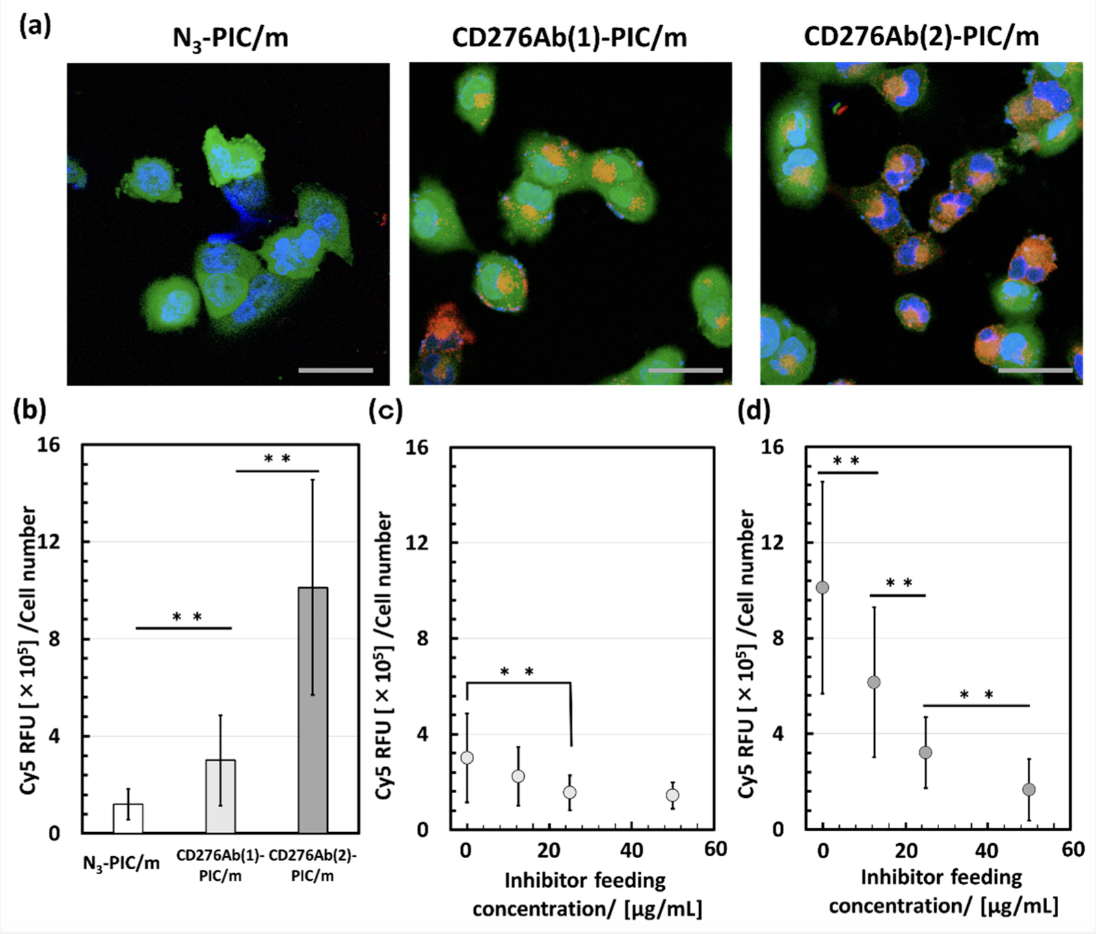
水野君の筆頭著者の論文が「Polymers」https://www.mdpi.com/2073-4360/15/7/1808に掲載されました。脳腫瘍へ特異的に薬剤を運ぶための高分子ミセルを開発した論文です。現在生体モデルへの適用を目指しています。

川内がワシントン日本大使館で開催されたThe 9th US-Japan conference on Oncologyhttps://www.amed.go.jp/news/event/20220617.htmlにおいて「Discovery and Understanding of Oncogenic Signaling for Pediatric Brain Tumors via Understanding of Human Cancer genomes」という表題で日独米の国際共同研究の成功例について発表しました。
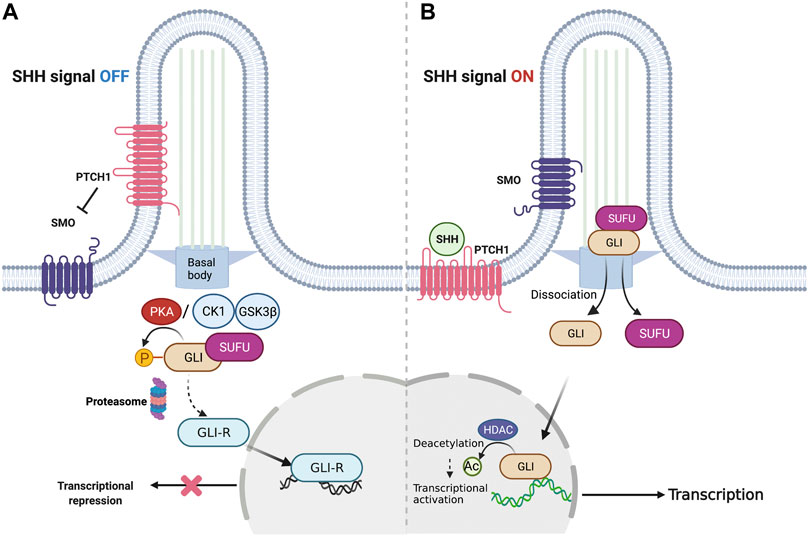
Wang君のSHHシグナルの総説が「Frontiers in Cell and Developmental Biology」https://www.frontiersin.org/articles/10.3389/fcell.2022.864035/fullに掲載されました。発生と発がんに関わるSHHシグナルを脳腫瘍研究の見地から書いています。

川内の研究提案「脳腫瘍と脳内微小環境のコミュニケーションを解明するコネクトミクス解析基盤の創出」が基盤研究Aに採択されました。脳神経と腫瘍細胞の相互作用を最先端のモデルを用いて明らかにしていきます。
本年度より、学術振興会特別研究員PDとして白石君と水野君が研究に参画してくれます。また東邦大から神宮さん、中国留学生の紀君と肖君が参加してくれます。
白石君と川内が白石椋・川内大輔 「個別化治療を目指した小児脳腫瘍の分子遺伝学的診断と腫瘍増殖メカニズム」と題して「疾患原因遺伝子」技術情報協会http://www.nts-book.co.jp/item/detail/summary/bio/20220331_263.htmlに分担執筆を行いました。わかりやすく小児脳腫瘍の内容を記述したので興味があればご覧ください。
川内が「Discovery and Understanding of Oncogenic Fusion Genes in Ependymoma」の表題で第6回世界連邦脳腫瘍学会https://www.wfnos2022.org/において口演を行いました。

川内がi-Seminarhttps://iseminar.weebly.com/でモデルマウスを用いた自身の最近の小児脳腫瘍研究「がんの動物モデルを利用した脳腫瘍の発がん機序の解明と治療標的分子の探索」という表題で発表しました。招待していただき有難うございます。
川内の研究提案が武田科学振興財団医学系研究助成https://www.takeda-sci.or.jp/research/assist/medicine.phpに採択されました。
SRCシグナルの様々な脳腫瘍におけるメカニズムの違いを探る研究提案です。
国際的な共同研究にも発展させたいと考えています。
以前我々が報告したSRC論文(Forget et al. Cancer Cell 2018)https://www.sciencedirect.com/science/article/pii/S1535610818303568?via%3Dihubの延長線上にある研究です。現在私が研究を担当しています。

川内が上阪直史教授(東京医科歯科大)と第44回日本神経科学学会でシンポジウム座長を務めました。Onlineでさせていただきましたが、シンポジストの皆様、素晴らしい発表を有難うございました。

白石君の髄芽腫の総説https://onlinelibrary.wiley.com/doi/full/10.1111/cas.14990が「Cancer Science」に掲載されました。最近注目されている髄芽腫のEpigeneticな発がん機構についてまとめた総説です。

本研究室とドイツがん研究センター、ハイデルベルク大学とのテント上上衣腫に関する国際共同研究が「Cancer Discovery」https://pubmed.ncbi.nlm.nih.gov/33879448/ (川内責任著者)に発表されました。この結果はWHO脳腫瘍分子分類(第5版)での改訂に貢献しました。

川内の研究提案がブレインサイエンス振興財団に採択されました。小脳顆粒細胞の分化機構をクロマチン制御の観点から解析していく予定です。白石君が髄芽腫解析の延長で担当してくれています。
川内の研究提案が小児医学研究振興財団の研究助成金に採択されました。
髄芽腫やSOTOS症候群で機能欠損変異のあるNSD1の小脳における機能を解析する研究です。王君が研究を担当してくれています。
本研究室とドイツがん研究センターとの共同研究が「Cancer Cell」に発表されました。iPSC由来のヒト腫瘍モデルを用いてDIPGの腫瘍起源を調べた論文です。
川内の研究提案が令和2年度高松宮妃癌研究基金研究助成金に採択されました。
川内の研究提案が2020年度上原記念生命科学財団研究助成金に採択されました。
第19回国際小児脳腫瘍学会シンポジウムhttp://ispno2020.umin.jp/で川内がシンポジストとして研究発表を行いました。
髄芽腫と上衣腫のマウスモデルを用いた基礎研究の成果を発表しました。
川内の研究提案が2020年度鈴木謙三記念医科学応用研究財団調査研究助成https://www.suzukenzaidan.or.jp/に採択されました。
国立がんセンターの市村幸一先生と共同ラボセミナーを行いました。
第79回日本癌学会シンポジウム「がん研究に不可欠なマウスモデル 」で川内がシンポジストとして発表しました。
第79回日本癌学会で大学院生の白石君がポスター発表(Web版)を行いました。
川内の研究提案が2020年度持田記念研究助成に採択されました。
本研究室の論文(川内責任著者)が「Genes and Development」オンライン版に発表されました。
クロマチンを制御するPRC1.1複合体形成に重要なBCORの変異がIGF2の発現を介してSHH型髄芽腫の腫瘍進展に関わっていることを示した論文です。
The Brain Tumour Charity 「Quest for Cures: Collaborative Discovery Teams」に採択されました。

AMED令和2年度「革新的がん医療実用化研究事業」に川内が研究代表者として本研究チームが採択されました。
脳腫瘍発生学研究チームを発足させました。

研究概要
私たちの研究グループは脳形成の分子機構を理解するために、脳腫瘍を材料に研究を行っています。
我々の脳細胞の分裂や分化は遺伝子プログラムによって厳密に制御されていますが、このプログラムが破綻すると脳細胞の異常増殖や脳内環境の変性が生じ、時に脳腫瘍という重篤な疾患を引き起こします。そのため「脳腫瘍が生じる機序を解明すること」と「正常脳の形成機構を理解すること」は表裏一体の研究分野です。その中で我々は、小児脳腫瘍の解明を目標とすることで、単なる神経発生の基礎研究に止まらない、医学分野への貢献を目的とした研究意義の高い問題に取り組んでいます。
脳腫瘍の機序を知る手がかりは、そのゲノムから得ることができます。近年、ゲノム解読技術の進歩により、様々ながんでゲノムが解読され、がん特異的な遺伝子の変異が見つかってきました。脳腫瘍も例外ではなく、特定の遺伝子で変異が高頻度で発見され、これらの変異が脳腫瘍を引き起こしていると推測されていますが、多くの場合、これら変異遺伝子の発がん性や機能はまだわかっていない状況です。
私たちの研究は、こうしたヒトで発見された様々な遺伝子変異が実際に脳の正常細胞をがん化させるのかどうか、その場合はどのようながんシグナルで腫瘍の形成を導くのか、といった脳腫瘍を発生する機序に興味を持ち、マウス遺伝学や分子生物学、生化学など様々な研究方法を用いて多角的に研究を行っています。また、実際に私たちが発見した発がん機序が治療に行かせるかどうかについて、腫瘍マウスモデルによる薬理実験なども精力的に行っています。
川内は最近までドイツがん研究センターで研究チームを持っていましたが、2019年末より病態生化学研究部で研究室を発足させました。
国内は脳腫瘍研究人口が少ないですが、国内外の多くの脳腫瘍研究室と密接に共同研究を行うことで、最新の脳腫瘍研究の情報を得ながら国際的に研究を進めています。また、日本国内での研究環境の利点を十分に活かし、学生さんやポスドクなど若い研究者と一緒に頑張っていきたいと思いますので、研究内容に興味があればメールや電話でお気軽に連絡ください。
また将来的に脳腫瘍研究で海外留学を考えている若い研究者の皆さんの相談もできる範囲でしますので、これまた気軽に連絡いただけたらと思います。
研究室長 川内 大輔
Project Gallery
現在、本研究チームで行っている研究です。ご意見やご質問はお気軽にいただけると嬉しいです。

01.クロマチン制御因子の小脳発生と髄芽腫形成における役割の解析
近年の次世代シーケンス技術の目覚ましい進歩により髄芽腫の分子解析は小児脳腫瘍の中でも理解が進んでいますが、その特徴の一つであるクロマチン制御因子の変異やそれに伴うエピゲノム変化が腫瘍形成にいかに関わっているのか、その生物学的意味は完全に理解できていないのが現状です。本研究テーマではマウス遺伝学とゲノム編集技術を駆使してクロマチン制御因子の正常な小脳発生における役割を理解することにより、その変異が腫瘍形成へどのように影響を与えるかを解析しています。
02.脳腫瘍特異的な融合遺伝子の発がん機能の解析
融合遺伝子は腫瘍ゲノムの不安定性が原因で生じるがん特異的な産物で、様々ながんの誘導や進展において非常に重要な役割を果たしていることが知られています。本研究では、脳腫瘍で特異的に発現する融合遺伝子が、どのように脳腫瘍形成に関わり、がんシグナルを産み出しているのかを生体内で明らかにし、その分子機構の側面から新規の治療法を提案したいと考えています。

03.高分子ミセルを用いた脳腫瘍特異的なDDSの開発
血液脳関門は脳を外界の異分子やウイルスから脳細胞を保護する重要な構造ですが、脳腫瘍の治療において薬剤を腫瘍に届ける際の障壁となります。また近年のがんの治療標的の生物学的な実験検証では主に生体内で行うことが治療に繋げるために重要とされています。現在、東京大学との共同研究により「高分子ミセル+脳腫瘍モデル」の異分野融合技術を用いて脳腫瘍DDSの開発を進めています。
研究業績
Shiraishi R, Kawauchi D. Epigenetic regulation in medulloblastoma pathogenesis revealed by genetically engineered mouse models. Cancer Sci. 2021:112(8):2948-2957.
Zheng T, Ghasemi DR, Okonechnikov K, Korshunov A, Sill M, Maass KK,Benites Goncalves da Silva P, Ryzhova M, Gojo J, Stichel D, Arabzade A, Kupp R, Benzel J, Taya S, Adachi T, Shiraishi R, Gerber NU, Sturm D, Ecker J, Sievers P, Selt F, Chapman R, Haberler C, Figarella-Branger D, Reifenberger G, Fleischhack G, Rutkowski S, Donson AM, Ramaswamy V, Capper D, Ellison DW, Herold-Mende CC, Schüller U, Brandner S, Driever PH, Kros JM, Snuderl M, Milde T, Grundy RG, Hoshino M, Mack SC, Gilbertson RJ, Jones DTW, Kool M, Deimling AV, Pfister SM, Sahm F*, Kawauchi D*, Pajtler KW*. Cross-species genomics reveals oncogenic dependencies in ZFTA/C11orf95 fusion-positive supratentorial ependymomas. Cancer Discov. (IF:39.397) 11(9):2230-2247. (2021) *Co-corresponding author.
Haag D, Mack N, Benites Goncalves da Silva P, Statz B, Clark J, Tanabe K, Sharma T, Jäger N, Jones DTW, Kawauchi D, Wernig M*, Pfister SM*. H3.3-K27M drives neural stem cell-specific gliomagenesis in a human iPSC-derived model. Cancer Cell. (IF:31.743) 39(3):407-422. (2021)
Kutscher LM, Okonechnikov K, Batora NV, Clark J, Silva PBG, Vouri M, van Rijn S, Sieber L, Statz B, Gearhart MD, Shiraishi R, Mack N, Orr BA, Korshunov A, Gudenas BL, Smith KS, Mercier AL, Ayrault O, Hoshino M, Kool M, von Hoff K, Graf N, Fleischhack G, Bardwell VJ, Pfister SM, Northcott PA, Kawauchi D*. Functional loss of a noncanonicalk BCOR-PRC1.1 complex accelerates SHH-driven medulloblastoma formation. Genes Dev. (IF:11.361) 34(17-18):1161-1176. (2020)
Pajtler KW, Wei Y, Okonechnikov K, Silva PBG, Vouri M, Zhang L, Brabetz S, Sieber L, Gulley M, Mauermann M, Wedig T, Mack N, Imamura Kawasawa Y, Sharma T, Zuckermann M, Andreiuolo F, Holland E, Maass K, Körkel-Qu H, Liu HK, Sahm F, Capper D, Bunt J, Richards LJ, Jones DTW, Korshunov A, Chavez L, Lichter P, Hoshino M, Pfister SM, Kool M, Li W*, Kawauchi D*. YAP1 subgroup supratentorial ependymoma requires TEAD and nuclear factor I-mediated transcriptional programmes for tumorigenesis. Nat Commun. (IF:14.919) 10(1):3914. (2019)
Forget A*, Martignetti L, Puget S, Calzone L, Brabetz S, Picard D, Montagud A, Liva S, Sta A, Dingli F, Arras G, Rivera J, Loew D, Besnard A, Lacombe J, Pagès M, Varlet P, Dufour C, Yu H, Mercier AL, Indersie E, Chivet A, Leboucher S, Sieber L, Beccaria K, Gombert M, Meyer FD, Qin N, Bartl J, Chavez L, Okonechnikov K, Sharma T, Thatikonda V, Bourdeaut F, Pouponnot C, Ramaswamy V, Korshunov A, Borkhardt A, Reifenberger G, Poullet P, Taylor MD, Kool M, Pfister SM, Kawauchi D*, Barillot E*, Remke M*, Ayrault O*. Aberrant ERBB4-SRC Signaling as a Hallmark of Group 4 Medulloblastoma Revealed by Integrative Phosphoproteomic Profiling. Cancer Cell. (IF:31.743) 34(3):379-395. (2018) *Co-corresponding author.
Kawauchi D*, Ogg RJ, Liu L, Shih DJH, Finkelstein D, Murphy BL, Rehg JE, Korshunov A, Calabrese C, Zindy F, Phoenix T, Kawaguchi Y, Gronych J, Gilbertson RJ, Lichter P, Gajjar A, Kool M, Northcott PA, Pfister SM, Roussel MF*. Novel MYC-driven medulloblastoma models from multiple embryonic cerebellar cells. Oncogene. (IF:9.867) 36(37):5231-5242. (2017) *Co-corresponding author.
Feng W#, Kawauchi D#,*, Körkel-Qu H, Deng H, Serger E, Sieber L, Lieberman JA, Jimeno-González S, Lambo S, Hanna BS, Harim Y, Jansen M, Neuerburg A, Friesen O, Zuckermann M, Rajendran V, Gronych J, Ayrault O, Korshunov A, Jones DT, Kool M, Northcott PA, Lichter P, Cortés-Ledesma F, Pfister SM*, Liu HK*. Chd7 is indispensable for mammalian brain development through activation of a neuronal differentiation programme. Nat Commun. (IF:14.919) 8:14758. (2017) #Co-first author. *Co-corresponding author.
Lin CY, Erkek S, Tong Y, Yin L, Federation AJ, Zapatka M, Haldipur P, Kawauchi D, Risch T, Warnatz HJ, Worst BC, Ju B, Orr BA, Zeid R, Polaski DR, Segura-Wang M, Waszak SM, Jones DT, Kool M, Hovestadt V, Buchhalter I, Sieber L, Johann P, Chavez L, Gröschel S, Ryzhova M, Korshunov A, Chen W, Chizhikov VV, Millen KJ, Amstislavskiy V, Lehrach H, Yaspo ML, Eils R, Lichter P, Korbel JO, Pfister SM*, Bradner JE*, Northcott PA*. Active medulloblastoma enhancers reveal subgroup-specific cellular origins. Nature. (IF:49.962) 530(7588):57-62. (2016)
Vo BT, Wolf E, Kawauchi D, Gebhardt A, Rehg JE, Finkelstein D, Walz S, Murphy BL, Youn YH, Han YG, Eilers M, Roussel MF*. The Interaction of Myc with Miz1 Defines Medulloblastoma Subgroup Identity. Cancer Cell. (IF:31.743) 29(1):5-16. (2016)
Zuckermann M, Hovestadt V, Knobbe-Thomsen CB, Zapatka M, Northcott PA, Schramm K, Belic J, Jones DT, Tschida B, Moriarity B, Largaespada D, Roussel MF, Korshunov A, Reifenberger G, Pfister SM, Lichter P, Kawauchi D*, Gronych J*. Somatic CRISPR/Cas9-mediated tumour suppressor disruption enables versatile brain tumour modelling. Nat Commun. (IF:14.919) 6:7391. (2015) *Co-corresponding author.
Northcott PA, Lee C, Zichner T, Stütz AM, Erkek S, Kawauchi D, Shih DJ, Hovestadt V, Zapatka M, Sturm D, Jones DT, Kool M, Remke M, Cavalli FM, Zuyderduyn S, Bader GD, VandenBerg S, Esparza LA, Ryzhova M, Wang W, Wittmann A, Stark S, Sieber L, Seker-Cin H, Linke L, Kratochwil F, Jäger N, Buchhalter I, Imbusch CD, Zipprich G, Raeder B, Schmidt S, Diessl N, Wolf S, Wiemann S, Brors B, Lawerenz C, Eils J, Warnatz HJ, Risch T, Yaspo ML, Weber UD, Bartholomae CC, von Kalle C, Turányi E, Hauser P, Sanden E, Darabi A, Siesjö P, Sterba J, Zitterbart K, Sumerauer D, van Sluis P, Versteeg R, Volckmann R, Koster J, Schuhmann MU, Ebinger M, Grimes HL, Robinson GW, Gajjar A, Mynarek M, von Hoff K, Rutkowski S, Pietsch T, Scheurlen W, Felsberg J, Reifenberger G, Kulozik AE, von Deimling A, Witt O, Eils R, Gilbertson RJ, Korshunov A, Taylor MD, Lichter P, Korbel JO, Wechsler-Reya RJ*, Pfister SM*. Enhancer hijacking activates GFI1 family oncogenes in medulloblastoma. Nature. (IF:49.962) 511(7510):428-34. (2014)
Wolf E, Gebhardt A, Kawauchi D, Walz S, von Eyss B, Wagner N, Renninger C, Krohne G, Asan E, Roussel MF, Eilers M*. Miz1 is required to maintain autophagic flux. Nat Commun. (IF:14.919) 4:2535. (2013)
Northcott PA, Shih DJ, Peacock J, Garzia L, Morrissy AS, Zichner T, Stütz AM, Korshunov A, Reimand J, Schumacher SE, Beroukhim R, Ellison DW, Marshall CR, Lionel AC, Mack S, Dubuc A, Yao Y, Ramaswamy V, Luu B, Rolider A, Cavalli FM, Wang X, Remke M, Wu X, Chiu RY, Chu A, Chuah E, Corbett RD, Hoad GR, Jackman SD, Li Y, Lo A, Mungall KL, Nip KM, Qian JQ, Raymond AG, Thiessen NT, Varhol RJ, Birol I, Moore RA, Mungall AJ, Holt R, Kawauchi D, Roussel MF, Kool M, Jones DT, Witt H, Fernandez-L A, Kenney AM, Wechsler-Reya RJ, Dirks P, Aviv T, Grajkowska WA, Perek-Polnik M, Haberler CC, Delattre O, Reynaud SS, Doz FF, Pernet-Fattet SS, Cho BK, Kim SK, Wang KC, Scheurlen W, Eberhart CG, Fèvre-Montange M, Jouvet A, Pollack IF, Fan X, Muraszko KM, Gillespie GY, Di Rocco C, Massimi L, Michiels EM, Kloosterhof NK, French PJ, Kros JM, Olson JM, Ellenbogen RG, Zitterbart K, Kren L, Thompson RC, Cooper MK, Lach B, McLendon RE, Bigner DD, Fontebasso A, Albrecht S, Jabado N, Lindsey JC, Bailey S, Gupta N, Weiss WA, Bognár L, Klekner A, Van Meter TE, Kumabe T, Tominaga T, Elbabaa SK, Leonard JR, Rubin JB, Liau LM, Van Meir EG, Fouladi M, Nakamura H, Cinalli G, Garami M, Hauser P, Saad AG, Iolascon A, Jung S, Carlotti CG, Vibhakar R, Ra YS, Robinson S, Zollo M, Faria CC, Chan JA, Levy ML, Sorensen PH, Meyerson M, Pomeroy SL, Cho YJ, Bader GD, Tabori U, Hawkins CE, Bouffet E, Scherer SW, Rutka JT, Malkin D, Clifford SC, Jones SJ, Korbel JO, Pfister SM, Marra MA, Taylor MD*. Subgroup-specific structural variation across 1,000 medulloblastoma genomes Nature. (IF:49.962) 488(7409):49-56. (2012)
Robinson G, Parker M, Kranenburg TA, Lu C, Chen X, Ding L, Phoenix TN, Hedlund E, Wei L, Zhu X, Chalhoub N, Baker SJ, Huether R, Kriwacki R, Curley N, Thiruvenkatam R, Wang J, Wu G, Rusch M, Hong X, Becksfort J, Gupta P, Ma J, Easton J, Vadodaria B, Onar-Thomas A, Lin T, Li S, Pounds S, Paugh S, Zhao D, Kawauchi D, Roussel MF, Finkelstein D, Ellison DW, Lau CC, Bouffet E, Hassall T, Gururangan S, Cohn R, Fulton RS, Fulton LL, Dooling DJ, Ochoa K, Gajjar A, Mardis ER, Wilson RK, Downing JR, Zhang J, Gilbertson RJ*. Novel mutations target distinct subgroups of medulloblastoma. Nature. (IF:49.962) 488(7409):43-8. (2012)
Kawauchi D, Robinson G, Uziel T, Gibson P, Rehg J, Gao C, Finkelstein D, Qu C, Pounds S, Ellison DW, Gilbertson RJ*, Roussel MF*. A mouse model of the most aggressive subgroup of human medulloblastoma. Cancer Cell.(IF:31.743) 21(2):168-180. (2012)

Profile
終身雇用権をもらったものの、疾患モデル研究をより加速させたいと考え帰国。
病態生化学研究部において小児脳腫瘍研究を国内で発展させたいと思っております。
小児脳腫瘍研究部門(Stefan M. Pfister部門長)において、脳腫瘍発生学研究グループのPI(2018年終身雇用権を取得)として、
様々な小児脳腫瘍の形成機構を解明しました。
Prof. Martine F. Roussel研究室で新規髄芽腫モデルの開発に従事し、世界初のGrp3型髄芽腫モデルを作成しました。
発生生物学領域(斎藤哲一郎教授)で電気穿孔法を用いて小脳における神経細胞の個性獲得の分子機構について研究しました。
学位取得後、細胞移動のメカニズムを継続して研究しました。
村上富士夫教授・小林裕明助教の指導の下、後脳の神経軸索の伸長機構や細胞移動のメカニズムを研究しました。
卒業研究で生物物理学講座(徳永史生教授)に在籍し、物理学から生物学特に脳研究をしたいと考える様になりました。

